在刚刚过去的2024年,基因与细胞治疗仍然是一级市场上最热门的投资赛道。
01 超50亿美元涌入
在仍然相对沉寂的2024年医疗健康一级市场上,基因与细胞治疗赛道的高度活跃,更显得十分亮眼。
根据动脉橙数据库,2024年,全球共157家基因与细胞治疗企业完成171次融资,累计募集资金超过51.9亿美金。根据此前发布的《2024年全球医疗健康投融资分析报告》,在2024年,基因与细胞治疗领域是整个医疗健康行业中,融资总金额最大、交易活跃度最高的细分领域。
然而,如果将观察视角深入会发现,到了2024年,国内外的基因与细胞治疗融资已经拉开明显。从最终的融资数据看,海外一级市场的基因与细胞治疗融资,是这个细分领域增长更重要差距的拉动力。
首先是融资节奏方面,海外的一级市场基因与细胞治疗投融资交易表现更加活跃。在国内,2024年,共有70家基因与细胞治疗企业完成了75笔融资交易,涉及金额超8.1亿美元。其中,莱芒生物全年公开融资3轮,累计募资超2000万美元;跃赛生物、引正基因、信级医药、荣泽集团,则均完成2轮融资。
相对而言,2024年基因与细胞治疗企业在海外的融资状况则更为火爆,全年共88家企业完成96笔融资交易。其中,HEPHAISTOS-Pharma全年公开融资3轮,累计募资超1200万美元;Vico Therapeutics、Santa Ana Bio、Neurona Therapeutics、Neurenati Therapeutics、Indapta Therapeutics、Brenus Pharma等6家企业,则均完成2轮融资。
其次是融资金额方面,由于2024年获得融资的海外基因与细胞治疗企业多为进入创业中后期的成熟项目,对应的融资金额也更高。2024年9月,总部位于美国加州的细胞治疗企业Arsenal Bio宣布完成3.25亿美元C轮融资,是全年金额最高的一次基因与细胞企业的单笔融资交易,也是这一赛道中,唯一跻身年度医疗健康融资金额TOP 10交易。而在国内,2024年4月,总部位于上海的细胞药物研发商信级医药,宣布完成3500万美元,成为年度国内基因与细胞治疗领域金额最高的一次融资。尚处于Pre-A轮融资阶段的信级医药所拿下的年度最高融资金额,在全球排名中则被挤出10名开外。
此外,值得注意的是,到了2024年,相比纯粹基于出色生物技术能力的创业项目,国内外资本更偏爱带有明显临床或者技术属性的基因与细胞治疗企业。
比如,获得赛道年度最高融资的Arsenal Bio,是实体瘤CAR-T领域的明星企业。这家公司的两位联合创始人,一位曾是一名肝移植外科医生,后从事风险投资,另一位则曾担任默克研究实验室的发现肿瘤学和免疫学副总裁,具备强大的临床和医学资源。而前面提到的信级医药,2023年成立于上海宝山区信级医药,作为上海生物研究院直属单位,信级医药依托上海生物研究院与浙江、江苏、上海等地110多家三甲级医院建立合作,开放临床患者招募绿色通道,商业化开发端的优势明显。
技术属性方面,前述一年拿下3轮融资的莱芒生物则以AI与生物技术相融合的特点,从一众同行中脱颖而出。成立于2021年莱芒生物,由瑞士洛桑联邦理工学院(EPFL)唐力教授团队联合晶泰科技创立,专注于免疫代谢重编程(Meta 10)+AI相结合的肿瘤免疫治疗创新药物研发。
当然,即便是在融资如此火热的年份,基因与细胞治疗领域的资金缺口仍然明显。2024年,动脉网的CGT园区行走过11个园区。在这个过程中,嘉宾们纷纷提到融资困境。一位从业这表示,很多的机会要非常主动积极去争取,因为现在能投的基金不多,但是缺钱的项目很多。另一位从业者则指出,要把有限的资源,聚焦到有限的管线里面,既要有创新,但是只能有限的创新;要有差异化,但要有确定性,其实还蛮难的。
02 商业化的爆发之年
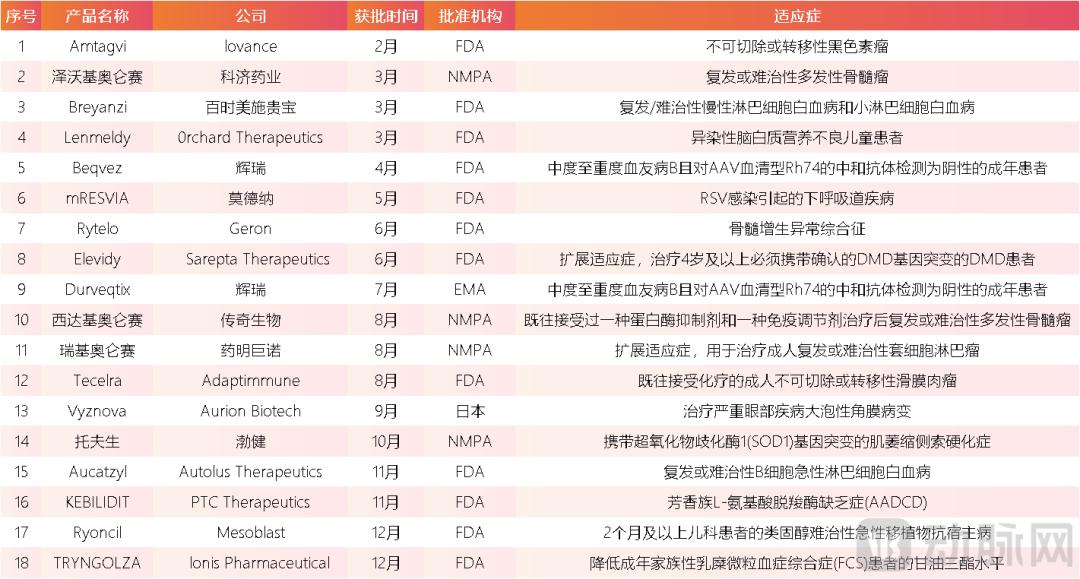
一级市场融资火热的背后,是在2024年,全球基因与细胞治疗产品密集取得重要进展。这种突破性的生物治疗方案,已经能够为许多人类重大疾病,提供仅有的解决方案。据动脉橙数据库不完全统计,2024年,全球共18款基因与细胞治疗产品获批上市,远超2023年的水平。更重要的是,其中不乏重磅的首发新药。
2024年获批上市的首发新药,将基因与细胞治疗临床应用的边界,向更多疾病领域拓展。2月16日,Iovance公司的Amtagvi(lifileucel)获美国FDA批准,成为全球首款用于治疗不可切除或转移性黑色素瘤的肿瘤浸润淋巴细胞疗法。在此之前,不可切除或转移性黑色素瘤患者大多通过靶向治疗,或者传统的放化疗来延长生存期。在一项国际多中心 II 期临床试验中,Amtagvi单药治疗不可切除或转移性黑色素瘤,客观缓解率达到31.4%,其中包含8例完全缓解和40例部分缓解,极大改善了这类患者的预后。
3月14日,百时美施贵宝的Breyanzi获FDA加速批准,用于治疗复发/难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤成人患者,上市价格41.03万美元。这也是全球首个获批用于治疗复发或难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤的 CAR-T 细胞疗法。在关键多中心试验 Transcend CLL004 中,完全缓解率为 20%,总缓解率为 45%,在达到完全缓解的患者中,未达到中位缓解持续时间,且血液中微小残留病阴性率为 100%,骨髓中为 92.3%。
此外,值得一提的是,在2024年8月,全球首个TCR-T疗法获批上市。这款名为Tecelra的TCR-T产品,由Adaptimmune公司开发,被FDA批准用于治疗既往接受化疗的成人不可切除或转移性滑膜肉瘤,定价72.7万美元。一直以来,TCR-T疗法被视为比CAR-T更进阶的细胞治疗方案,但商业化进展十分缓慢。而Tecelra的获批,无疑极大点燃了TCR-T领域的开发和投资热情。
据动脉橙数据库统计,截至2024年末,全球获批上市的基因与细胞治疗药物已经超过50款。不过,从上市后的商业化表现看,这个赛道距离跑出重磅炸弹药物,无疑还有很长一段路要走。
而从已经公布的商业化数据看,2024年,除了西达基奥仑赛注射液外,大多数基因与细胞治疗的明星产品销售仍不理想。数据显示,2024年,西达基奥仑赛注射液销售额总计9.63亿美元,相较2023年增长92.7%。而Kymriah、Abecma等,在2024年则出现了不同程度的销售额缩水。
一边是大量新产品密集获批上市,另一边是临床应用的普及相对缓慢,基因与细胞治疗的商业化混战似乎在所难免。数据显示,两款国产细胞治疗产品瑞基奥仑赛和泽沃基奥仑,自上市以来并没有带来突破性的营收贡献。数据显示,2024年上半年,瑞基奥仑赛注射液贡献营收8681.5万元,泽沃基奥仑赛则卖出约为600万元。
03 商业化拐点何时出现?
到了2025年,随着越来越多的企业和研究机构进入,在研管线和临床试验数量不断增加,产品同质化竞争问题逐渐显现,基因与细胞治疗的商业化或将陷入红海之争。但始终制约着这类创新疗法的两大瓶颈,仍然有待解决。
一方面,基因与细胞治疗本身还存在较大的安全性风险。这也是这种技术在临床上的广泛应用收到制约的关键瓶颈。比如,存在递送系统风险,基因治疗常用的AAV载体对肝脏有高亲和力,可能诱导免疫系统攻击,存在肝毒性,还可能导致染色体重排和脱靶风险增加,甚至引发癌症。再如,编辑工具可能带来的问题,基因与细胞治疗中常用的CRISPR/Cas9等基因编辑工具,本质是改变DNA序列,在机体修复过程中可能产生杂乱无章的基因序列,脱靶风险较高,可能影响肿瘤抑制基因等,带来安全隐患。
另一方面,成本高、定价贵,能够覆盖的患者群体有限。正是由于基因与细胞治疗的技术成熟度仍然有限,这类产品的应用被限制在十分有限的范围内,管理要求是相当严苛。以基因疗法为例,病毒载体生产需要大规模工厂,生产工艺复杂,质量控制难度大,导致成本居高不下,如一些基因治疗产品因病毒载体生产成本高而价格昂贵。在现有的技术条件下,基因与细胞治疗研发需要大量资金、人才和时间投入,从实验室研究到临床试验再到产品上市,过程复杂,风险大,许多创新药企面临资金压力和研发失败风险,从供给端降低定价的空间有限。
而在支付端,这种与基本医保的保障定位不符,通过常规准入进入国家医保目录难度大。尽管部分商业保险、地方惠民保将一些细胞与基因治疗产品纳入保障范围,但受既往症、支付上限等限制,保障范围、赔付力度和覆盖面有限,无法满足患者需求。
从某种意义上讲,基因与细胞治疗的商业化混战或许比拐点更早到来。但随着技术本身的不断完善,去覆盖更广阔的患者群体,我们相信这种创新疗法,会成为临床上十分重要的治疗工具。
本文来自微信公众号 ,作者:王世薇,36氪经授权发布。

还没有评论,来说两句吧...